- Մարդկությանը հուզող ինչպիսի՞ էկոլոգիական հիմնախնդիրներ գիտեք, թվարկեք…
Մարդկությանը հուզող էկոլոգիական հիմնախնդիրները լինում են էներգետիկ (էլեկտրաէներգիա, վառելիք), առողջապահական (էկոլոգիապես մաքուր սնունդ, մաքուր խմելու ջուր, մաքուր կենսական միջավայր)։ - Ի՞նչ կարծիք ունեք կենսական միջավայրի մասին
Կենսական միջավայրը շատ կեղտոտ է։ Օդում կան վտանգավոր գազեր որոնք ազդում են մեր առողջության վրա։ Ջուրը պարունակում է վտանգավոր նյութե, մետաղներ և այլն։ - Որո՞նք են առողջ ապրելակերպի սկզբունքները
Առողջ ապրելակերպի սկզբունքներն են լավ կենսական միջավայրը, ակտիվ ապրելակերպ վարելը և էկոլոգիապես մաքուր սնունդ։ - Ինչպիսի՞ թունավոր նյութեր կան օդում, հողում և ջրում
Տարատեսակ տարրեր, անպիտան նյութեր, գազեր, փոշի, աղբ։ - Ո՞րն է համարվում էկոլոգիապես մաքուր սնունդ
Էկոլոգիապես մաքուր սնունդը դա այն սնունդն է, որը պատարստվում է առանց վտանգ սպառնալով բնությանը։ - Որո՞նք են սննդանյութերի օրգանոլեպտիկ հատկությունները
Սննդանյութերի օրգանոլեպտիկ հատկություններից են սննդի գույնը, հոտը, համը, տեսքը։ - Ի՞նչ է <<նիտրատային աղետը>>
1970-ական թվականներին աշխարհի տարբեր երկրներում հանելուկային թունավորումների բռնկումներ գրանցվեցին: Ինչպես պարզվեց՝ պատճառը նիտրատներն էին, որոնք մեծ քանակություններով օգտագործվել էին, որպես պարարտանյութ: Ահա թե ինչու նիտրատներ պարունակող սննդամթերքներով զանգվածային թունավորումներն անվանվեցին նիտրատային աղետ: - Ո՞րն է համարվում մաքուր խմելու ջուր
Ջուրը համարվում է խմելու, եթե գույնը թափանցիկ է, հոտ չի գալիս, 100 մանրէից ավել չպիտի պարունակի և պետք է լինի քաղցրահամ՝ կալիումական և նատրիումական հանքային աղեր: - Ի՞նչ վնասակար հատկություններ ունի քլորով հագեցած ջուրը
Քլորը վտանգավոր է մեր օրգանիզմի համար - Որո՞նք են ջրի ախտոտման տեսակները
Ջուրը աղտոտման հիմնական տեսակներից են՝ ածխաջրածինները, մակերևույթային ջրերը, ստորգետնյա աղտոտումը, թթվածնի կլանիչները, մանրէաբանական աղտոտվածությունը, կախված նյութերով աղտոտվածությունը, ջրի քիմիական աղտոտումը, սննդային աղտոտվածությունը։ - Ի՞նչ է թորած ջուրը, ինչպե՞ս են ստանում թորած ջուր:
Թորած ջուրը թորման եղանակով հանքային աղերից, օրգանական ու անօրգանական նյութերից և այլ խառնուրդներից մաքրված ջուրն է։ Թափանցիկ է, անգույն և չեզոք։ Մաքրման աստիճանը կախված է կիրառման նպատակներից։ Պահում են անագե փակ անոթներում կամ քիմիապես կայուն շշերում։ Թորած ջուրը պիտանի չէ խմելու համար։ Երկարատև օգտագործումը առաջացնում է ստամոքս-աղիքային համակարգի գործունեության խանգարում։
Рубрика: Քիմիա 9
Գործնական աշխատանք․ լուծույթների պատրաստությունը և կոնցենտրացիաի որոշումը
- Պատրաստել խմելու սոդայի (NaHCO3) 2% 200-գ ջրային լուծույթ։
Ա․ Քանի գրամ սոդա է պետք վերցնել m (NaHCO3)= ?գ
Բ․ Քանի գրամ ջուր է պետք վերցնել m (H2 O)= ?գ
100գ- 2գ
200- x
2 x 200/ 100= 4 Պատ․՝ 4
200գ — 4գ= 196գ Պատ․՝ 196գ
Քանի որ ջրի խտությունը 1գ v(H2 O)= 196մլ
2. Որոշել ստացված լուծույթում սոդայի մոլային կոնցենտրացիա։ Cm (NaHCO3 )= n (NaHCO3 )/ V (լուծույթ)= մոլ․/Լ
n= m/M= 4գ/ 84 մոլ= 0․05 մոլ
Cm= 0,05մոլ/ 0,2 լ= 0,25
3.Որոշել ստացված լուծույթում լուծված նյութի կամ սոդայի մոլային բաժինը։
X (NaHCO3 )= n(NaHCO3 )/ n(NaHCO3 ) + n(H2 O) • 100%
Համար մեկ տարը տիեզերքում․ Ջրածին
1․Ինչո՞ւ է ջրածինը համարվում համար մեկ տարրը Տիեզերքում…
Տիեզերքի հիմնական նյութը ջրածինն է: Աստղերի վրա ըն– թացող ջրածնի ատոմների փոխարկումը մի այլ տարրի’ հելիումի, ուղեկցվում է հսկայական քանակով ջերմության և լույսի անջատումով: Նման միջուկային գործընթացներ են տեղի ունենում Արեգակի՝ մեզ առավել մոտ գտնվող աստղի վրա: Առանց նշված փոխարկման կյանքն անհնար կլիներ Երկրի վրա:
Լաբարատոր փորձեր․ Աղաթթվի քիմիական հատկություններ 15.03.24
Լաբորատոր փորձեր՝ <<Աղաթթվի քիմիական հատկությունները>>
Փորձ 1. Հայտանյութերի ( մեթիլնարնջագույն, լակմուս, ֆենոլֆտալեին) գույնի փոփոխությունը թթվային միջավայրում:
Փորձ 2. Ցինկի քլորիդի ստացումը`տեղակալման ռեակցիայի օգնությամբ` ցինկի և աղաթթվի փոխազդեցությամբ: Գրեք Ձեր կողմից իրականացրած ռեակցիայի հավասարումը և որոշեք. ա) ռեակցիայի հետևանքով ստացված աղի զանգվածը (գ), բ) անջատված ջրածնի ծավալը ( լ, ն.պ. ),եթե փորձի համար վերցրել եք m գ մետաղ:
Փորձ 3. Իրականացրեք չեզոքացման ռեակցիա նատրիումի հիդրօքսիդի և աղաթթվի միջև: Գրեք համապատասխան ռեակցիայի հավասարումը և որոշեք ռեակցիայի հետևանքով ստացված աղի՝ նատրիումի քլորիդի զանգվածը (գ), եթե փորձի համար օգտագործել եք նատրիումի հիդրօքսիդի 10 գ 10%-անոց լուծույթ:
Փորձ 4. Իրականացրեք փոխանակման ռեակցիա նատրիումի հիդրոկարբոնատի(խմելու սոդա) և աղաթթվի միջև: Գրեք ընթացող ռեակցիայի հավասարումը և հաշվեք ռեակցիան իրականացնելու համար անհրաժեշտ նատրիումի հիդրոկարբոնատի զանգվածը, որպեսզի ռեակցիայի հետևանքով անջատվի 0,05 մոլ ածխաթթու գազ:
Համար մեկ տարը տիեզերքում` ջրածին 22.03
1․Ինչո՞ւ է ջրածինը համարվում համար մեկ տարրը Տիեզերքում…
Ջրածինը համարվում է Տիեզերքում համար մեկ տարըը, որովհետև միացությունների ձևով ջրածինը չափազանց տարածված տարր է: Նա կազմում է ջրի զանգվածի 11%-ը, մտնում է բոլոր բուսական` մրգերի, բանջարեղենների, թթուների, և կենդանական նյութերի` ճարպերի, սպիտակուցների, ածխաջրերի, նավթի, և շատ այլ հանքային նյութերի բաղադրության մեջ: Նա կազմում է արեգակի և աստղերից շատերի զանգվածի կեսից ավելին: Արեգակնային համակարգի ամենամեծ մոլորակը` Յուպիտերը, համարյա ամբողջովին կազմված է ջրածնից:
2․Ջրածինը համարվում է ապագայի վառելանյութ. ինչո՞ւ. …
Ջրածինը համարվում է ապագայի վառելանյութ, քանի որ ջրածնի այրման ժամանակ մեծ քանակությամբ ջերմություն է անջատվում: Ջրածնի այրումից առաջացած ջերմությունը շատ ավելի մեծ է քան ցանկացած այլ վառելանյութի այրումից: Հենց մեր օրերում ստեղծում են վառելանյութը, լաբորատոր փորձերի և ուսումնասիրությունների միջոցով:
3․ Բնութագրեք ջրածին քիմիական տարրը.
ա) քիմիական նշանը- H
բ) հարաբերական ատոմային զանգվածը- 1,00797
գ) մետա՞ղ է. թե՞ ոչ մետաղ- ոչ մետաղ
դ) դիրքը պարբերական համակարգում.այսինքն ո՞ր պարբերության և ո՞ր խմբի տարր է- կարգաթիվ՝ 1, խումբ՝ առաջին, պարբերությունէ առաջին
ե) ջրածնի իզոտոպների բաղադրությունը (միջուկի լիցքը. ..,միջուկում պրոտոների թիվը…,էլեկտրոնների թիվը, էներգետիկ մակարդակների թիվը ) — միջուկի լիցքը-1 միջուկում պրոտոների թիվը-1 էլեկտրոնների թիվը-1 էներգետիկ մակարդակների թիվը -1
4․Ջրածնի վալենտականությունը և օքսիդացման աստիճանը միացություններում.գրեք նյութերի օրինակներ և անվանեք
Ջրածնի վալենտականությունը 1 է: Օքսիդացման աստիճանը -1 է հիդրիթներում, մնացած միացություններում ունի +1 օքսիդացման աստիճան։
Լաբարատոր աշխատանք․ սպիտակուցի բնափոխումը
Ազդանյութեր՝ Ձվի սպիտակուցի լուծույթ, կաթ, աղաթթվի՝ HCl-ի 10%-անոց լուծույթ կամ քացախաթթվի 10%-անոց լուծույթ (քացախ):
Փորձի ընթացքը: Փորձանոթի մեջ լցնել 10 մլ ձվի սպիտակուցի լուծույթ կամ էլ նույն քանակով կաթ, ավելացնել 3 մլ HCl-ի 10%-անոց լուծույթ կամ 5 մլ քացախաթթվի 10%-անոց լուծույթ (քացախ); Փորձանոթի պարունակությունը զգուշությամբ տաքացնել թափահարելով մինչև նկատվեն սպիտակուցի մակրոմոլեկուլները:
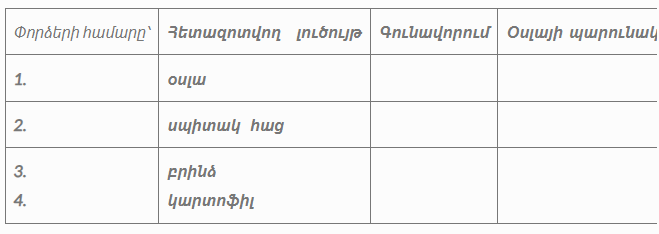
Լաբորատոր փորձեր՝ <<Օսլայի բացահայտման ռեակցիաները տարբեր սննդանյութերում>>
Լաբորատոր փորձեր՝ <<Օսլայի բացահայտման ռեակցիաները տարբեր սննդանյութերում>>
Բույսերի հիմնական պաշարային ածխաջուրը՝ օսլան, յոդի լուծույթի նույնիսկ չնչին կոնցենտրացիայի առկայությամբ ստանում է մուգ կապույտ գունավորում (առաջանում է համալիր միացություն)։ Գունավորումը պայմանավորված է ամիլոզի առկայությամբ։ Չնայած ամիլոպեկտինի պարունակությունը օսլայում մի քանի անգամ շատ է ամիլոզի քանակությունից, ամիլոզի կապույտ գունավորումը քողարկում է ամիլոպեկտինի կարմրամանուշակագույն գունավորումը։ Տաքացման հետևանքով համալիրը քայքայվում է, գունավորումն անհետանում, սառչելու դեպքում՝ նորից հայտնվում։ Այս ռեակցիան թույլ է տալիս հայտնաբերել միջավայրում օսլայի նույնիսկ աննշան քանակությունը։
Աշխատանքի համար անհրաժեշտ է.
- Օսլայի լուծույթներ
- Յոդով գունավորված օսլայի լուծույթի անգունացում (տաքացնելու դեպքում)
- Լուծույթի գունավորման առաջացում (սառեցնելու դեպքում):
Նյութեր և ռեակտիվներ: Կարտոֆիլ, սպիտակ հաց, բրինձ, խնձոր, օսլայի 1% լուծույթ, Լյուգոլի ռեակտիվ:
Պարագաներ: Փորձանոթներ, կաթոցիչներ, փորձանոթի բռնիչ
Աշխատանքի ընթացքը. Փորձանոթում պատրաստել օսլայի լուծույթ և կաթոցիկով կաթեցնել Լյուգոլի ռեակտիվը առաջանում է կապտամանուշակագույն գունավորում։Փորձանոթների մեջ տեղավորել տարբեր սննդանյութեր (նախապես հավանգում տրորած), ավելացնել 2-3 մլ թորած ջուր, թափահարել, ավելացնել մի քանի կաթիլ Լյուգոլի ռեակտիվ։ Փորձանոթներումառաջացած գունավորմամբ եզրակացնել սննդանյութերում օսլայի քանակության մասին։
Գունավորման արդյունքները գրանցել աղյուսակում
Լաբորատոր փորձեր՝ սպիտակուցների հայտնաբերման և բնափոխման ռեակցիաներ
Փորձ 1. Սպիտակուցի քսանտոպրոտոնային ռեակցիան. պեպտիդային կապի
հայտնաբերումը բիուրետային ռեակցիայով
Ազդանյութեր՝ ձվի սպիտակուցի լուծույթ, CuSO4 2%-անոց լուծույթ և NaOH 10%-անոց լուծույթ:
Փորձի ընթացքը. Փորձանոթի մեջ լցնել 10-12 կաթիլ ձվի սպիտակուցի լուծույթ, ավելացնել նույն ծավալով NaOH-ի 10%-անոց լուծույթ և զգուշորեն պատով սահեցնելով՝ ավելացնել 2-4 կաթիլ CuSO4-ի լուծույթ: Նկատվում է կապտամանուշակագույն գունավորում:
Փորձ 2. Պեպտիդային կապի հայտնաբերումը <<Մարիաննա>> ֆիրմայի կաթում
Ազդանյութեր՝ կաթ, CuSO4 2%-անոց լուծույթ և NaOH 10%-անոց լուծույթ:
Փորձի ընթացքը. Փորձանոթի մեջ լցնել մոտ 10 մլ կաթ և նոսրացնել ջրով, ավելացնել 5մլ NaOH-ի 10%-անոց լուծույթ և զգուշորեն պատով սահեցնելով՝ ավելացնել 2-4 կաթիլ CuSO4-ի լուծույթ: Նկատվում է կապտամանուշակագույն գունավորում, որը պեպտիդային կապի հայտնաբերումն է բիուրետային ռեակցիայով:
https://youtu.be/fBra_OYTskM
Անօրգանական շղթա 24.11.2023
Էջ 17
Ռեակցիաներ
1) Mg + O2 = MgO + Q
2Mg + O2 = 2MgO
2) MgO + H2 O= Mg (HO2)
3) Mg (OH2) + HQ =
Լաբորատոր փորձեր 17.11.23
Այրման ռեակցիաներ
Հաշվարկային լաբորատոր փորձեր`«Անօրգանական նյութերի ծագումնաբանական կապը».
- Մետաղ-հիմնային օքսիդ-հիմք-աղ` Mg → MgO →Mg(OH)2 → MgCl2
- Ոչ մետաղ→ թթվային օքսիդ→ թթու→ աղ` P→P2O5→H3PO4 →Na3PO4
Առաջադրանք. 1. Գրեք իրականացրած ռեակցիաների հավասարումները և կատարեք հաշվարկ. որքա՞ն աղ կստացվի, եթե <<հրավառության>> համար վերցրել եք 2,4գ մագնեզիում,ընդունել, որ բոլոր ռեակցիաները ընթանում են քանակապես:
Առաջադրանք 2. Գրեք իրականացրած ռեակցիաների հավասարումները և կատարեք հաշվարկ. որքա՞ն աղ կստացվի, եթե այրել եք 6,2գ ֆոսֆոր,ընդունել, որ բոլոր ռեակցիաները ընթանում են քանակապես:
Կրկնել. ա) անվտանգության կանոնները քիմիայի կաբինետում աշխատելիս
բ) ֆիզիկական, քիմիական երևույթները
գ) քիմիական ռեակցիաների հատկանիշները
դ) քիմիական ռեակցիաների տեսակները
ե) անօրգանական նյութերի հիմնական դասերը՝ օքսիդներ, հիմքեր,
թթուներ,աղեր
զ) օքսիդներ, սահմանել, դասակարգել, ֆիզիկաքիմիական
հատկությունները:
Փորձ 1
Բժկական սպիրտի այրման րեակցիա
Բանաձև-
Ռեակցիա- C2 H6 O + O2= CO2 + H2 O + Q
Պահանջ․ Հավասարեցնել
Փորձ 2
Հրավառություն
Mg+ O2 = MgO + Q
nyuti akas m nyuti qanaky sosoryilklnj nmsen Molayin zangavac
Ճարպեր
Ճարպերը գլիցերոլի և ճարպաթթունների եթերներ են։ Այս ճարպերը (տրիգլիցերիդները) և ճարպանման օրգանական բնույթի այլ նյութեր խմբավորվում են լիպիդներ ընդհանուր անվամբ, որոնց համար ընդհանուրը ջրում անլուծելի լինելն է։ Լիպիդները բաժանվում են 2 խմբի՝
1. պարզ՝ ճարպաթթուներ, տրիգլեցերիդներ (չեզոք ճարպեր), լիպոսպիրտներ (խոլեստերոլ, ռետինոլ, կալցիֆերոլ)
2. բարդ՝ ֆոսֆոլիպիդներ և գլիկոլիպիդներ։
Ճարպերի քանակը կենդանի օրգանիզմում կազմում է 5%
Ճարպերը, ի տարբերություն սպիտակուցների, հստակ չեն բաժանվում լիարժեք և ոչ լիարժեք խմբերի, որովհետև և՛ կենդանական և՛ բոաական ծագման ճարպերը չեն բավարարում այն բոլոր պայմանները, որ առաջարկվում է լիարժեք ճարպին, այսպես, կենդանական ճարպերը պարունակում են վիտամին A և վիտամին D, բայց չհագեցած ճարպաթթուներն այստեղ շատ քիչ են, նույնիսկ կաթնային ճարպը շատ աղքատ է ԳՉՃԹ-ով, չնայած պարունակում է արախիդոնաթթու։ Բուսական ճարպերը, ընդհակառակը, չեն պարունակում վիտամին A և վիտամին D, խոլեստերին և արախիդոնաթթու, բայց հագեցած են ֆոսֆոլիպիդներով, լինոլաթթվով, տոկոֆերոլով։
Ճարպերն ունեն էնեոգետիկ նշանակություն, 1 գ ճարպի քայքայումից անջատվում է 9 կկալ էներգիա։ Նրանց ֆունկցիան հիմնականում պայմանավորված է չեզոք ճարպերով, որոնց քանակն առողջ չափահաս մարդու մոտ կազմում է մարմնի զանգվածի 16-23%-ը։ Ճարպերի ընդհանուր քանակի 10-12 կգ-ից միայն 2 կգ-ն է կազմում կոնստիտուցիոնալ ճարպը, իսկ մյոաը կուտակված է ադիպոցիտներում։ Այն կարող է տալ մոտ 9000 կկալ էներգիա և քաղցի դեպքում ապահովել մարդու կենսունակությունը 40 օրվա ընթացքում (օրը 2200 կկալ)։
